Lic. Oddone Sebastian
Ácido fosfórico
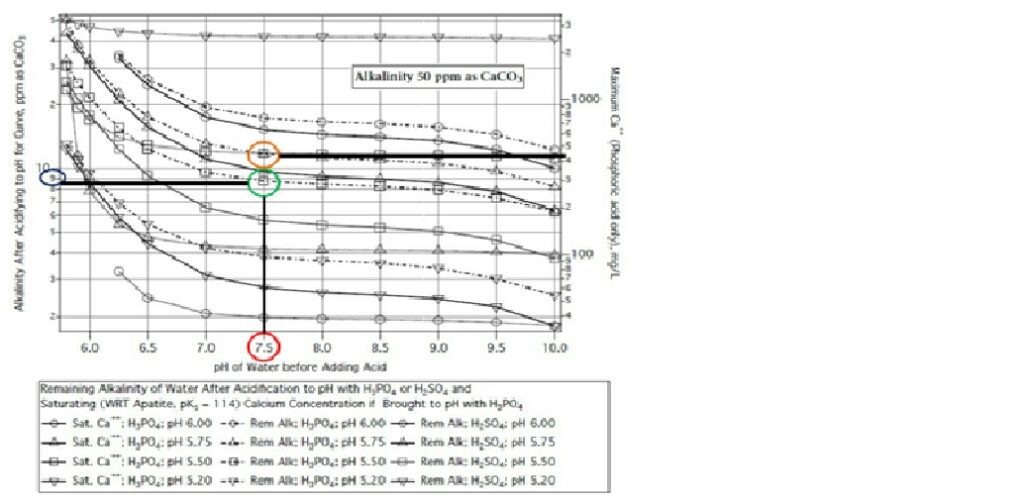
John Palmer presenta en su libro “Water: a Comprehensive Guide for Brewers” una metodología para poder estimar la cantidad de ácido fosfórico que se debe agregar al agua de lavado.Al momento de ajustar el agua de lavado, uno se debe concentrar en la capacidad buffer del agua, que es la que debe sortear. Ya no se debe tener tan en cuenta el efecto de las maltas sobre el pH (esto sí en el caso del agua de macerado). Lo ilustra Palmer muy bien con un ejemplo:Suponer que se cuenta con un agua que tiene la siguiente composición:16 ppm de Calcio50 ppm de Alcalinidad total (como CaCO3)pH 7,5, y pequeñas cantidades de magnesio, cloruro, sodio y sulfato. El objetivo es acidificar el agua de lavado a un pH cercano al pH del macerado (ejemplo, pH=5,5). La pregunta es ¿cuánto ácido fosfórico debo agregar? Para ello, ver la siguiente figura adaptada de su libro: Podemos ver como partiendo de pH inicial del agua 7,5 (círculo rojo), y cruzando con la curva de líneas y cuadraditos (círculo verde / usando fosfórico para llegar a 5,5), nos encontramos con una alcalinidad residual igual a 9 ppm (círculo azul). Luego, si la alcalinidad total fue de 50 ppm, y la alcalinidad residual queda en 9 ppm, es necesario reducir en 41 ppm la alcalinidad para lograr ese pH final objetivo. Dividiendo el cambio en la alcalinidad por su peso equivalente (50), obtenemos el siguiente valor: Esto significa que se requieren 0,82 mEq de ácido por litro de agua para neutralizar la alcalinidad. En el caso del fosfórico al ser poliprótico (ácido débil), una aproximación más nos daría 0,80 mEq/litro (ver Palmer). Si contamos con una solución concentrada de ácido fosfórico 85%, luego es conveniente preparar una solución de concentración 1N (68 ml de ácido al 85% en 1 litro de solución). 1 N significa 1 mEq/ml. Conclusión necesitaríamos agregar al agua 0,8 ml por cada litro. Para 100 litros de agua se requieren 80 ml de la solución 1 N del ácido. También se puede observar en el mismo gráfico la pérdida de calcio como consecuencia de la precipitación de hidroxiapatita (reacción entre el fosfórico y el calcio). El círculo naranja con la intersección del eje de la derecha muestra que algo más de 400 ppm de calcio se requieren para que comience el efecto de precipitación con fosfórico. En nuestro caso ejemplo, el agua contiene solo 16 ppm de calcio, por lo tanto, no habría pérdida por precipitación del mismo.
Fuente consultada: John Palmer, Colin Kaminski. Water: A Comprehensive Guide for Brewers